Forschende der Universitätsmedizin Mainz untersuchen Rolle des Mikrobioms bei der Entstehung von Darmerkrankungen
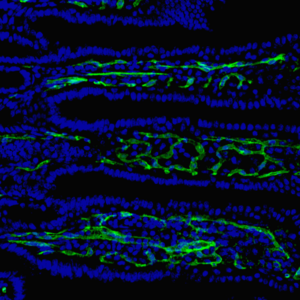
Bildunterschrift: Forschende am CTH der Universitätsmedizin Mainz haben gezeigt, dass Darmbakterien die Darmbarriere schwächen und dadurch die Entstehung von Darmerkrankungen beeinflussen können. Das Bild zeigt eine mikroskopische Aufnahme von Dünndarmzotten mit Kapillargefäßen (grün) und Zellkernen (blau). Bildquelle: © Universitätsmedizin Mainz / Christoph Reinhardt
Ein Forschungsteam des Centrums für Thrombose und Hämostase (CTH) der Universitätsmedizin Mainz hat erstmals gezeigt, dass Darmbakterien die sogenannte Darmbarriere schwächen können. Dabei hemmen sie den sogenannten Hedgehog-Signalweg. Dieser ist maßgeblich dafür verantwortlich, dass sich eine funktionierende Darmbarriere bildet. Die Darmbarriere steuert die Nährstoffaufnahme und verhindert, dass schädigende Substanzen aufgenommen werden. Ist sie gestört, können chronisch-entzündliche Darmerkrankungen und Darmkrebs entstehen. Die in der Zeitschrift Nature Metabolism veröffentlichten Forschungsergebnisse sind grundlegend, um neue Therapien für Darmerkrankungen entwickeln zu können.
Der Darm beherbergt über 100 Billionen Bakterien – das sind mehr als ein Mensch aus Körperzellen besteht. Die Gesamtheit der Mikroorganismen im Darm wird auch als Mikrobiom oder Darmflora bezeichnet. Die Aufgaben der Darmbakterien sind vielfältig: Sie helfen zum Beispiel bei der Verdauung, verhindern, dass sich Krankheitserreger ansiedeln und trainieren das Immunsystem. Es gibt jedoch auch Bakterien, die zum Beispiel Blähungen oder Verdauungsprobleme verursachen können. Bislang ist nicht bekannt, über welche Mechanismen das Mikrobiom den Darm und seine Gesundheit beeinflussen kann.
„Wir konnten erstmals identifizieren, welcher Signalweg für eine stabile Darmbarriere relevant ist und wie das Darmmikrobiom diese beeinflussen kann. Wie stark sich die Darmbarriere ausprägt, bestimmt ein Mechanismus im Darmepithel, der als Hedgehog-Signalweg bezeichnet wird. Die Darmbakterien können diesen wichtigen Hedgehog-Signalweg hemmen und so die Darmbarriere schwächen“, erläutert Dr. Giulia Pontarollo, die Erstautorin der Publikation und wissenschaftliche Mitarbeiterin am CTH.
Um unter den Billionen Darmbakterien die Zusammenhänge einer Bakterienart im Detail erkennen zu können, haben die Mainzer Forschenden eine besondere Methode angewendet: die sogenannte Gnotobiotik. „Mit dieser Methode können wir die Wechselwirkung der Bakterien mit dem Organismus entschlüsseln, indem wir unter keimfreien Bedingungen im Tiermodell eine einzelne Interaktion spezifisch untersuchen. Nur so lassen sich die nützlichen von den schädigenden Bakterien unterscheiden“, erklärt Univ.-Prof. Dr. Christoph Reinhardt, Arbeitsgruppenleiter am Centrum für Thrombose und Hämostase (CTH) der Universitätsmedizin Mainz und Mitglied im Gutenberg Forschungskolleg (GFK).
Die Forschenden stellten fest, dass die Interaktion der Bakterien mit der Darmbarriere einen Mechanismus auslöst, durch den das Protein Neuropilin-1 im Darmepithel abgebaut wird. Ohne dieses wichtige Protein sinkt die Aktivität des Hedgehog-Signalwegs. Dies führt dazu, dass die Zellentwicklung gestört ist und weniger stabilisierende Bestandteile im Darmepithel gebildet werden. Die Folge: eine geschwächte und durchlässige Darmbarriere.
Darüber hinaus entdeckte das Forschungsteam, dass ein Mangel an Neuropilin-1 die Bildung von Gefäßen in den Darmzotten beeinträchtigt. Diese Kapillargefäße sind besonders wichtig, um Nährstoffe effektiv aufnehmen zu können.
„Diese neuen Erkenntnisse sind essentiell, um zu verstehen, wie durch das Mikrobiom Entzündungsreaktionen im Darm und die Entstehung von Darmkrebs gefördert werden. Unser Ziel ist es, dieses Wissen in die klinische Forschung zu überführen, um gezielt neue therapeutische Strategien ableiten zu können“, so Professor Reinhardt.
Das Forschungsteam des CTH kooperierte in seinem Forschungsprojekt unter anderem mit dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK), dem Translational Animal Research Center (TARC) der Universitätsmedizin Mainz sowie mit dem Universitätsklinikum Frankfurt (Priv. Doz. Dr. Christoph Welsch).
Quelle:
Universitätsmedizin Mainz
Originalpublikation:
Pontarollo, G., Kollar, B., Mann, A. et al. Commensal bacteria weaken the intestinal barrier by suppressing epithelial neuropilin-1 and Hedgehog signaling. Nat Metab (2023).
DOI: https://doi.org/10.1038/s42255-023-00828-5
